Jacob Puliyel, C Sathyamala
pubblicato il 5/09/2017
pubblicato il 5/09/2017
Abstract
Ci sono stati diversi rapporti spontanei di morte improvvisa inattesa subito dopo la somministrazione di Infanrix hexa (vaccino combinato di difterite, tetano, pertosse acellulare, poliomielite inactivata, epatite B e Haemophilus influenzae tipo B). Il produttore, GlaxoSmithKline (GSK), presenta relazioni confidenziali periodiche di aggiornamento sulla sicurezza (PSUR) su Infanrix Hexa all’Agenzia europea dei medicinali (EMA). L’ultimo è il PSUR * 19 [PSUSA * secondo la recente denominazione]. Ogni PSUR contiene un’analisi di morti improvvise osservate/ attese, che dimostra che il numero di morti osservate subito dopo l’immunizzazione è inferiore a quelle previste per caso.
Questo commento si concentra su quell’aspetto del PSUR che influisce sulle decisioni politiche. Abbiamo analizzato i dati forniti nei PSUR. E’ evidente che le morti riconosciute nel PSUR 16 sono state eliminate dal PSUR 19. Il numero di morti osservate subito dopo la vaccinazione nei bambini di età superiore ad un anno era significativamente superiore a quello previsto per caso una volta che le morti cancellate sono state ripristinate e incluse nell’analisi.
Il produttore deve spiegare le cifre che sono state presentate alle autorità regolatorie. Le procedure intraprese dall’EMA per valutare le segnalazioni del fabbricante nel PSUR devono essere rivedute. Il Controllore Generale dei medicinali dell’India accetta quasi automaticamente i farmaci e i vaccini approvati dall’EMA. C’è bisogno di rivedere la fiducia in merito alla diligenza da parte dell’EMA.
Introduzione
Il 23 ottobre 2000, la commercializzazione di due esavalenti vaccini, Infanrix hexa® (GlaxoSmithKline plc-GSK) ed Hexavac® (Sanofi Pasteur MSD, SNC), che combinano la difterite, il tetano, la pertosse acellulare, l’epatite B, la poliomielite inattivata e l’influenza Haemophilus tipo B è stata autorizzata nell’Unione europea. Dopo l’autorizzazione, ci sono stati diversi rapporti spontanei di morte improvvisa inaspettata subito dopo la somministrazione di questi vaccini esavalenti. Nel 2005 von Kries e colleghi (1) hanno eseguito un’analisi dettagliata in cui hanno confrontato le morti osservate subito dopo la vaccinazione con le morti attese casuali. Hanno trovato che il rapporto di mortalità standardizzato (SMR) entro due giorni dalla vaccinazione di Hexavac era significativamente aumentato nei bambini vaccinati nel secondo anno di vita.
Questo non era il caso di Infanrix Hexa. Su richiesta del titolare dell’autorizzazione all’immissione in commercio, l’Hexavac è stato ritirato nel 2005 e l’Infanrix Hexa ha continuato ad essere commercializzato in Europa (2). Secondo la legge europea, l’Agenzia europea dei medicinali (EMA) è responsabile per la protezione della salute pubblica attraverso la valutazione dei medicinali da essa approvati come autorità di regolamentazione. I produttori sono responsabili dell’efficacia, qualità e sicurezza dei loro farmaci (3).
La corte italiana del giudice Nicola Di Leo ha reso disponibili al pubblico i rapporti confidenziali periodici di aggiornamento sulla sicurezza (PSUR) 15 e 16a dal 2009 al 2011 della GlaxoSmithKline (4). Il PSUR 19 (che incorpora i PSUR 17, 18 e 19, datato 15 gennaio 2015) è stato ottenuto dalla dottoressa LB dall’EMA ai sensi dell’articolo 3 delle regole EMA (EMA 110196/2006 del 30 novembre 2010) (5). La dottoressa LB ha inviato questo PSUR al primo autore (JP), chiedendogli di scrivere un rapporto da presentare al Parlamento europeo. Questo commento è basato su tutti questi PSURs. Nel contesto dell’aspetto della sicurezza precedentemente evidenziato da von Kries (1), questo commento esamina la morte improvvisa dopo l’uso del vaccino Infanrix Hexa. Altri aspetti trattati nei PSUR non sono esaminati.
PSUR 15 – raggruppamento di morti dopo la vaccinazione
PSUR 15 – raggruppamento di morti dopo la vaccinazione
La maggior parte delle morti che si verificano nel periodo post-neonatale sono dovute alle infezioni, ai difetti congeniti, malignità o incidenti. Raramente i bambini muoiono senza una causa evidente e così le morti sono classificate come (i) sindrome della morte improvvisa (SIDS), definito nel PSUR come morte che si verifica nel primo anno di vita e rimane inspiegabile dopo l’autopsia, o (ii) morte improvvisa inaspettata (SUD), definita come la morte che si verifica entro i primi due anni di vita, e che rimane inspiegabile dopo storia clinica e finale degli eventi, ma senza autopsia. Insieme, questi due sono considerati come morte improvvisa (SD) nel PSUR 15.
Un determinato numero di vaccini viene somministrato in un dato giorno a bambini sotto i 2 anni e il numero dei bambini vaccinati in tutto il mondo è molto grande. È possibile che casualmente alcuni bambini vaccinati possano morire di SIDS / SUD incidentalmente, tali eventi si sarebbero verificati anche se questi bambini non fossero stati vaccinati in quel giorno. Per accertare se una tale morte è stata causata dalla vaccinazione o era un evento incidentale, viene eseguita un’analisi di SD osservata / attesa. L’analisi valuta se il numero di decessi osservato dopo la vaccinazione supera quello che si può prevedere per caso.
Morti improvvise: osservate verso attese
Il PSUR 15 spiega come questa analisi è stata eseguita (4: p 782): “La Società ha valutato se il numero di morti improvvise riportate in questa fascia di età che hanno superato il numero uno potevano verificarsi casualmente. Poiché la distribuzione dell’età in cui i soggetti sono stati vaccinati è sconosciuta, la società ha assunto che la proporzione di eventi avversi per età è rappresentativa dell’effettiva distribuzione dell’età alla vaccinazione. Si può quindi stimare che il 90,6% di tutti i destinatari di Infanrix Hexa erano nel loro primo anno di vita, e il 9,4% era nel secondo anno di vita. Quindi il numero delle dosi (dal lancio) è stato stimato pari a 54.927.729 e 5,698,904, rispettivamente. Dato che la Germania è il paese principale dove vengono distribuite le dosi Infanrix Hexa (quasi il 30% solo in Germania), si è supposto che l’incidenza di morte improvvisa osservato in Germania fosse rappresentativo dell’intera popolazione di destinatari di Infanrix Hexa (Ufficio federale tedesco della Statistica, Statistisches Bundesamt; tasso di incidenza nel primo anno di vita: 0,454 / 1000 nascite vive; secondo anno: 0.062 / 1000 nascite vive, dati 2008).
“Il PSUR documenta la morte riportata entro 20 giorni dalla vaccinazione. Il numero di morti osservate era inferiore a quello previsto (tabella 1).
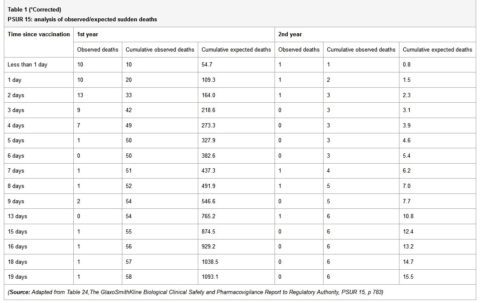 Tuttavia, tra i neonati, c’era un raggruppamento delle morti immediatamente dopo la vaccinazione, con 42 morti che si verificavano nei primi tre giorni dopo la vaccinazione e solo 8 nei prossimi 3 giorni. Tra coloro che avevano meno di un anno di età, 54 morti (93%) si sono verificati nei primi dieci giorni e 4 (7%) nei successivi 10 giorni. Se le morti fossero state “morti casuali di SIDS”, questa disparità nel numero di decessi nei due periodi di tempo non sarebbe stato osservato.
Tuttavia, tra i neonati, c’era un raggruppamento delle morti immediatamente dopo la vaccinazione, con 42 morti che si verificavano nei primi tre giorni dopo la vaccinazione e solo 8 nei prossimi 3 giorni. Tra coloro che avevano meno di un anno di età, 54 morti (93%) si sono verificati nei primi dieci giorni e 4 (7%) nei successivi 10 giorni. Se le morti fossero state “morti casuali di SIDS”, questa disparità nel numero di decessi nei due periodi di tempo non sarebbe stato osservato.
 Tuttavia, tra i neonati, c’era un raggruppamento delle morti immediatamente dopo la vaccinazione, con 42 morti che si verificavano nei primi tre giorni dopo la vaccinazione e solo 8 nei prossimi 3 giorni. Tra coloro che avevano meno di un anno di età, 54 morti (93%) si sono verificati nei primi dieci giorni e 4 (7%) nei successivi 10 giorni. Se le morti fossero state “morti casuali di SIDS”, questa disparità nel numero di decessi nei due periodi di tempo non sarebbe stato osservato.
Tuttavia, tra i neonati, c’era un raggruppamento delle morti immediatamente dopo la vaccinazione, con 42 morti che si verificavano nei primi tre giorni dopo la vaccinazione e solo 8 nei prossimi 3 giorni. Tra coloro che avevano meno di un anno di età, 54 morti (93%) si sono verificati nei primi dieci giorni e 4 (7%) nei successivi 10 giorni. Se le morti fossero state “morti casuali di SIDS”, questa disparità nel numero di decessi nei due periodi di tempo non sarebbe stato osservato.Le morti per SIDS sarebbe state distribuite uniformemente nel periodo di 20 giorni.
Il fatto che il tasso di morti diminuisce rapidamente con il passaggio del tempo che segue l’immunizzazione, suggerisce che le morti potrebbero essere correlate alla vaccinazione.
Allo stesso modo, tra i bambini di età superiore a un anno, 5 morti (83,3%) si sono verificati nei primi 10 giorni e si è verificata una morte (17%) nei successivi 10 giorni. Il raggruppamento dei decessi riportati nello PSUR 15 è stato notato anche nel PSUR 16, e questo è stato commentato in precedenza (6).
La risposta di GlaxoSmithKline
In risposta a questa critica (7), l’amministratore delegato (CEO) di GlaxoSmithKline (GSK), Sir Andrew Witty, attraverso il dottor Norman Begg, Chief Medical Officer della società, , ha suggerito in una lettera che c’è molta più probabilità di pensare ad una potenziale associazione causale e quindi di segnalare un evento avverso a GSK se si verifica poco dopo la vaccinazione piuttosto che se si verifica settimane dopo. Ha inoltre scritto: “Alla luce di quanto sopra, rimaniamo fiduciosi nelle conclusioni precedentemente raggiunte da GSK e condivise con le agenzie regolatorie e le autorità sanitarie in tutto il mondo, che i dati attualmente disponibili non suggeriscono un aumentato il rischio di morte improvvisa infantile dopo la vaccinazione con Infanrix hexa. Se i dati e le informazioni disponibili cambiassero e suggerissero che ci sia un aumento del rischio, rimaniamo impegnati a notificare prontamente le autorità e a prendere le azioni necessarie per comunicare tali dati e informazioni agli operatori sanitari “.
Questa risposta contiene una tacito ammissione che non c’era la vigilanza attiva durante il periodo post-vaccinazione e solo le morti segnalate spontaneamente a GSK sono state incluse sotto la voce “morti osservate”. Ciò potrebbe causare una sottovalutazione delle morti dopo la vaccinazione. È da notare che per “morti attese” viene utilizzato il numero di dosi di vaccino distribuito. Nel report è riconosciuto che tutte le dosi del vaccino distribuito non sono state necessariamente utilizzate. In questo modo, le cifre di “morti attese” sono risultate gonfiate.
Tuttavia, vista la spiegazione e la garanzia del CEO che la GSK si è impegnata a notificare prontamente alle autorità e professionisti del settore sanitario di qualsiasi aumento del rischio con Infanrix Hexa, la questione del raggruppamento delle morti non è stata indagata ulteriormente.
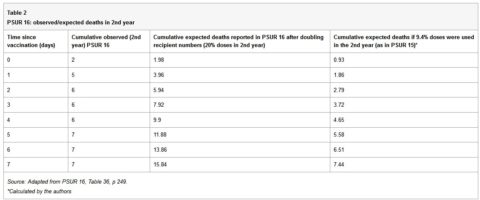
PSUR 16: raddoppiamento delle morti attese
Se tutti i bambini che hanno ricevuto la prima dose del vaccino ricevono in tutto quattro dosi e l’ultima dose è somministrata nel secondo anno di vita, allora si può stimare che un quarto (25%) delle dosi vengono somministrate a bambini di età superiore ad un anno. Questo è il programma vaccinale raccomandato in Germania. Tuttavia, alcuni paesi, come l’Italia, consigliano solo tre dosi, tutte nel primo anno e nessuna nel secondo. Inoltre, non tutti i bambini ricevono tutte le dosi raccomandate. Quindi è improbabile che il 20% -25% delle dosi venga utilizzato nel secondo anno. Nel PSUR 15, è stato stimato che il 90,6% delle dosi vendute venisse utilizzato in neonati sotto l’anno di età e il 9,4% per quelli al di sopra di un anno di età. Nel PSUR 16, la stima delle dosi ricevute il secondo anno è più che raddoppiato (dal 9,4% al 20%), e quindi la stima delle morti attese è raddoppiata. Nonostante il raddoppiamento del le morti attese, il numero di morti osservate nel secondo anno era superiore a quello atteso nei primi 3 giorni dopo la vaccinazione (Tabella 36, p249). Se la stima nel PSUR 15 che il 9,4% delle dosi vengono utilizzate nel secondo anno è corretta, ciò vale anche per il PSUR 16, e quindi le morti osservate risultano superiori alle morti attese nei primi 7 giorni.

PSUR 19: le morti previste ponderate per paese e proporzione annuale delle dosi
Nel PSUR 19, una media ponderata in base al calendario dei tassi d’incidenza di morti improvvise tedesca, francese e olandese è stata calcolata per arrivare all’incidenza attesa di morti improvvise.
In termini molto semplici, questo significa che se il 60% della dosi sono state distribuite in Germania in un determinato anno, al tasso di SD (Sudden Death) in Germania è stato dato un peso del 60% al momento del calcolo del tasso di SD complessivo per quell’anno; se il 30% è stato distribuito in Francia, il tasso di SD in Francia ha contribuito per il 30%, e il peso del 10% è stato dato al tasso SD olandese. Infine, il tasso globale di SD è stato calcolato per tutti gli anni insieme.
Il tasso complessivo di SD è stato calcolato come 0.0102 / 1000 nascite vive per il secondo anno. Questa cifra è un sesto della frequenza attesa utilizzata nei PSUR 15 e 16 (che calcolavano le morti improvvise a 0,062 / 1000 nascite vive, utilizzando i dati tedeschi).
L’intervallo di confidenza (CI) di Poisson del 95% delle morti osservate nel secondo anno è riportato nella tabella 8 a p 447 del PSUR 19. È riportato che per il secondo anno di vita, il numero di morti osservate era più elevato, anche se non significativamente, di quello delle morti attese entro un periodo di rischio di 1-4 giorni dopo la vaccinazione.
Morti mancanti nel PSUR 19
Dal PSUR 16 al PSUR 19, le dosi totali del vaccino sono salite da 69 a 112 milioni. Secondo il PSUR 19, è stato assunto che il 20,2% delle dosi distribuite sia stato somministrato ai bambini nel secondo anno di vita (PSUR 19, pp 436-448). I casi di morte in cui l’età della vaccinazione non era noto, la data del decesso non era registrata, o il tempo del decesso superava i 19 giorni dalla vaccinazione, sono stati esclusi.
Il PSUR 19 (morti fino al 22 ottobre 2014) non segnala le morti improvvise menzionate nel PSUR 16 (casi di morte che sono avvenuti fino al 22 ottobre 2011). È da notare che nel PSUR 16 l’età del bambino morto dopo la vaccinazione e il tempo del decesso (entro 14 giorni dalla vaccinazione) sono stati entrambi registrati.
Le morti cumulative riportate sono più basse nel PSUR 19 rispetto al PSUR 16. Quanto ai bambini al di sopra di un anno, il PSUR 19 registra il verificarsi di soli 5 morti nei primi 19 giorni dopo la vaccinazione, mentre il PSUR 16 ne riporta 8. I numeri non sono coerenti tra di loro. Ci chiediamo perché sia così.
Dieci anni dopo la pubblicazione dell’articolo del CDC (Centro per il Controllo delle Malattie) che esaminava il rapporto tra il vaccino contro morbillo, parotite e rosolia (MMR) e autismo (8), uno degli autori, William Thompson, ha ammesso che lui e i suoi co-autori hanno omesso di mostrare informazioni statisticamente significative che maschi afro-americani che avevano ricevuto l’MMR prima dell’età di 36 mesi presentavano un aumento del rischio di autismo (9). Gli autori hanno cancellato i dati dei bambini che non avevano il certificato di nascita in Georgia (10), in modo da escludere uno sproporzionato numero di bambini neri, e hanno presentato i loro dati in modo da dimostrare che non vi era stato un aumento del rischio.
Non è chiaro se gli autori del PSUR 19 hanno similmente escluso bambini morti e documentati nel PSUR 16.
La tabella 3 presenta le morti osservate e attese riportate nel PSUR 19 e le morti osservate dopo il ripristino delle morti riportate nel PSUR 16.
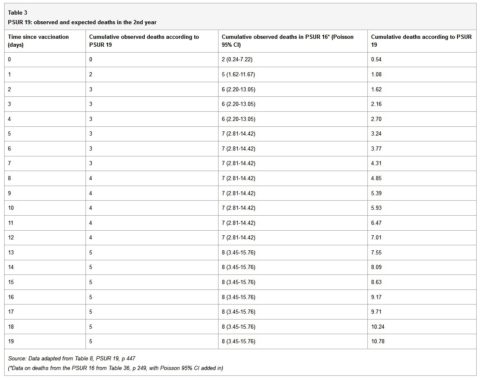

Quando vengono utilizzati i dati delle morti osservate nel PSUR 16, il numero di morti osservate è significativamente superiore al previsto per i primi quattro giorni dopo la vaccinazione. Dev’essere tenuto presente, come spiegato in precedenza, che poiché il numero delle morti osservate è raccolto in modo passivo, è probabile che sia sottostimato. Le morti attese, d’altra parte, sono probabilmente sovrastimate in quanto vengono calcolate con il presupposto che tutte le dosi distribuite siano state utilizzate senza alcuna perdita e nessun vaccino sia stato scartato perché scaduto. GSK avrebbe dovuto segnalare l’aumento del rischio statisticamente significativo di morte nei quattro giorni dopo la vaccinazione all’autorità regolatoria e ai medici.
Le dosi utilizzate nel secondo anno
Il PSUR 19 presuppone che il 20,2% delle dosi sia stato utilizzato il secondo anno. Esso afferma che la distribuzione dell’età in cui i soggetti sono vaccinati è sconosciuta, e l’azienda ha ipotizzato che la proporzione di eventi avversi (tra cui la morte) per età è rappresentativo della distribuzione effettiva dell’età alla vaccinazione. Così, poiché il 20,2% degli eventi avversi si è verificato nei bambini al di sopra di un anno di età, la società ha assunto che il 20,2% delle dosi siano state usate per questo gruppo di età.
È facile stimare il numero di dosi utilizzate nel secondo anno sulla base degli eventi avversi osservati (compresa la morte), poi utilizzare questa stima delle dosi per calcolare il numero di morti attese, e infine confrontarlo con il numero di morti osservate – dato che la stima delle morti attese è calcolata in primo luogo dagli eventi negativi osservati (inclusa la morte).
Supponendo che tutte le morti dopo la vaccinazione siano di SIDS / SUD coincidenti e non causali correlate al vaccino, e dato che (secondo il PSUR 19) la frequenza naturale della morte improvvisa nel primo anno è 44 volte superiore a quella nel secondo anno (0.441 / 1000 nel primo anno e 0.0102 / 1000 nel secondo anno), devono essere vaccinati 44 volte in più di bambini nel secondo anno per raggiungere lo stesso numero di morti come nel primo anno.
In una coorte di 100 morti, se il 20% di morti improvvise si verificano nel secondo anno e l’80% nel primo anno, 880 bambini [20 x 44 N.d.T.] devono essere vaccinati nel secondo anno per ogni 80 vaccinati nel primo anno. In questo caso, si verrebbe ad assumere che il 91% di tutte le dosi di Infanrix hexa sarebbe stato utilizzato nel secondo anno e solo il 9% nel primo anno (invece del contrario). Ciò riflette l’assurdità di calcolare la distribuzione della dose per età, sulla base della distribuzione dell’età degli eventi avversi, come fatto nel documento GSK.
L ‘unico modo per valutare il numero di dosi utilizzate nel secondo anno è quello di esaminare i programmi di vaccinazione in differenti paesi – guardando quali paesi consigliano la quarta dose nel secondo anno e quali non consigliano le dosi nel secondo anno. Può essere assegnato un peso per il numero di dosi distribuite in questi paesi. Il tasso di abbandono (bambini che abbandonano il programma di vaccinazione dopo aver ricevuto le prime dosi di vaccino) devono essere considerate anche nel calcolo finale della percentuale di dosi utilizzate nel secondo anno. Sembrerebbe che una stima ragionevole delle dosi utilizzate nel secondo anno sia il 9,4% delle dosi totali e questa è la cifra utilizzata il PSUR 15.
Il dilemma etico – il problema del carrello
Questo commento non cerca di esaminare se questi eccessivi decessi dopo la vaccinazione (presumibilmente causati dal vaccino) può essere compensato dalle vite salvate dalla malattia con la prevenzione ottenuta con il vaccino. Nel suo classico esperimento mentale, chiamato il “dilemma del carrello” (trolley dilemma), Philippa Foot chiede se è etico reindirizzare un carrello sfuggito da una pista ferroviaria che avrebbe ucciso cinque persone in un’altra pista dove solo uno sarebbe morto (11). In una variante del dilemma del carrello, la persona singola sulla pista alternativa è il figlio della persona che può commutare le piste. Judith Thomson assume che le vite cinque possono essere salvate con trapianti di organi da un donatore sano, e chiede se sarebbe etico uccidere intenzionalmente una persona per salvare gli altri cinque (12). Gli etici sostengono che il fine non può giustificare i mezzi. Se si cela la morte dopo la vaccinazione, si può impedire / ritardare la valutazione del profilo di sicurezza del vaccino e questo ha il potenziale di causare più morti inutili, difficilmente giustificabili eticamente.
Rilevanza per l’India
L’autorità regolatoria del governo dell’India è la Drug Controller General of India (DCGI). Secondo le regole del DCGI, i farmaci approvati in uno o più paesi, ad esempio Stati Uniti, Regno Unito, Canada, Giappone, Australia e paesi dell’Unione europea, vengono approvati anche in India (13). Sono necessari solo studi integrativi per la valutazione dell’impatto di fattori etnici sull’efficacia, sicurezza, dosaggio e regimi di dosaggio dei farmaci (14).
Recentemente, studi che esaminano l’immunogenicità e la sicurezza del vaccino combinato esavalente in piccole sperimentazioni sono stati pubblicati in India (15,16). Inoltre, Indian Pediatrics ha pubblicato un editoriale intitolato “vaccinazioni esavalenti: il futuro dell’immunizzazione di routine?” (17), il quale ha suggerito che questo vaccino combinato sarebbe stato promosso in India. È fondamentale che l’autorità regolatoria in India sia consapevole delle preoccupazioni sollevate in questo commento sui rapporti PSUR, in particolare perché i sistemi di sorveglianza in India sono deboli.
Sommario e conclusione
Von Kries (1) riportò un aumento statisticamente significativo del SMR nei bambini nel loro secondo anno di vita, entro due giorni dalla vaccinazione con Hexavac® (uno dei due vaccini esavalenti autorizzati, ora ritirato).
Nelle relazioni periodiche di aggiornamento sulla sicurezza, GSK, la società di produzione di Infanrix hexa, valuta se il numero delle morti improvvise riportate dopo la vaccinazione con il loro farmaco, ha superato il numero che potrebbe essere previsto per caso. Il raggruppamento delle morti subito dopo l’immunizzazione suggerisce che la morte potrebbe essere stata causata dal vaccino.
Inoltre, la nostra analisi mostra che le morti riconosciute nel PSUR 16 sono state eliminate dal PSUR 19. Le morti osservate vengono segnalate spontaneamente al GSK e sono probabilmente sottostimate. Aggiungendo le morti cancellate dal PSUR 16, esiste un aumento del rischio di morte statisticamente significativa nei primi quattro giorni dopo la vaccinazione, rispetto alle morti attese. I produttori dovranno spiegare perché queste morti non sono state incluse nel PSUR 19. L’aumento del rischio di morte non è stato comunicato all’autorità regolatoria o al personale sanitario che somministra questo vaccino.
Tenuto conto di quanto detto sopra, è difficile capire come l’EMA possa aver accettato il PSUR 19 a titolo nominale. Si può sostenere che non è stata esercitata la dovuta diligenza, per cui numerosi bambini sono stati esposti inutilmente al rischio di morte.
Il DCGI deve essere messo a conoscenza delle limitazioni presenti nel PSUR di Infanrix Hexa.
– Riferimenti –
- von Kries R, Toschke AM, Strassburger K, Kundi M, Kalies H, Nennstiel U, Jorch G, Rosenbauer J, GianiG. Sudden and unexpected deaths after the administration of hexavalent vaccines (diphtheria, tetanus, pertussis, poliomyelitis, hepatitis B, Haemophilus influenzae type b): is there a signal? Eur J Pediatr. 2005 Feb; 164(2):61-9. Epub 2004 Dec 16.
- European Medicines Agency (EMEA). Press Release. EMEA recommends suspension of Hexavac. London, September 20, 2005. Doc. Ref. EMEA/297369/2005 [cited 2017 May 12]. Available from: https://lakemedelsverket.se/upload/nyheter/2005/PressmedEMEA%5B1%5D.pdf
- Directive 2001/83/EC of the European Parliament and of the Council of November 6, 2001 on the community code relating to medicinal products for human use. Official Journal L–311, 28/11/2004, p. 67-128 [cited 2017 May 3]. Available from: http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/10/WC500004481.pdf
- GlaxoSmithKline Biological clinical safety and pharmacovigilance’s confidential report to the EMA: PSUR 15 and PSUR 16 [cited 2017 Aug 1]. Available from: http://autismoevaccini.files.wordpress.com/2012/12/vaccin-dc3a9cc3a8s.pdf
- GlaxoSmithKline Biological clinical safety and pharmacovigilance’s confidential report to the EMA: PSUR 19 [cited 2017 Aug 1]. Available from: http://ijme.in/wp-content/uploads/2017/09/infanrix-pusr.pdf
- Puliyel J. PubMed Commons comment on Baldo V, Bonanni P, Castro M, Gabutti G, Franco E, Marchetti F, Prato R, Vitale F. Combined hexavalent diphtheria-tetanus-acellular pertussis-hepatitis B-inactivated poliovirus-Haemophilus influenzae type B vaccine; Infanrix hexa™: twelve years of experience in Italy. Hum Vaccin Immunother. 2014 [cited 2017 Aug 1]; 10(1):129-37. doi: 10.4161/hv.26269. Epub 2013 Sep 4. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24004825#cm24004825_8656.
- Sir Andrew Witty, CEO GlaxoSmithKline, responds through Norman Begg, Chief Medical Officer, GSK Vaccines, to Infanrix controversy related to PSUR 16 [cited 2017 Aug 1]. Available from: http://ijme.in/wp-content/uploads/2017/09/infanrix-gsk-cmo-response.pdf
- DeStefano F, Bhasin TK, Thompson WW, Yeargin-Allsopp M, Boyle C. Age at first measles-mumps-rubella vaccination in children with autism and school-matched control subjects: a population-based study in metropolitan Atlanta. Pediatrics. 2004 Feb; 113(2):259-66.
- Morgan FM. Statement of William W Thompson, PhD, regarding the 2004 article examining the possibility of a relationship between MMR and autism dated August 27, 2015 [cited 2017 Aug 3]. Available from: https://leftbrainrightbrain.co.uk/2014/08/28/statement-of-william-w-thompson-ph-d-regarding-the-2004-article-examining-the-possibility-of-a-relationship-between-mmr-vaccine-and-autism/
- CDC. CDC Statement Regarding 2004 Pediatrics Article, “Age at first measles-mumps-rubella vaccination in children with autism and school-matched control subjects: a population-based study in metropolitan Atlanta”[cited 2017 Aug 2]. Available from: https://www.cdc.gov/vaccinesafety/concerns/autism/cdc2004pediatrics.html
- Foot PR. The problem of abortion and the doctrine of the double effect. In: Virtues and vices. Oxford: Basil Blackwell; 1978.
- Thomson JJ. The trolley problem. The Yale Law Journal. 1985 May; 94(6):1395-415.
- Central Drugs Standard Control Organisation Delhi. Guidelines on approval of clinical trial and new drugs. Available at http://www.cdsco.nic.in/writereaddata/Guidance_for_New_Drug_Approval-23.07.2011.pdf Accessed on 2 August 2017
- Liu JP, Chow SC. Bridging studies in clinical development. J Biopharm Stat. 2002; 12:359-67.
- Chhatwal J, Lalwani S, Vidor E. Immunogenicity and safety of a liquid hexavalentvaccine in Indian infants. Indian Pediatr. 2017 Jan 15; 54(1):15-20. Epub 2016 Nov 5.
- Lalwani SK, Agarkhedkar S, Sundaram B, Mahantashetti NS, Malshe N, Agarkhedkar S, Van Der Meeren O, Mehta S, Karkada N, Han HH, Mesaros N. Immunogenicity and safety of 3-dose primary vaccination with combined DTPa-HBV-IPV/Hib in Indian infants. Hum Vaccin Immunother. 2017 Jan 2; 13(1):120-7. doi: 10.1080/21645515.2016.1225639. Epub 2016 Sep 15.
- Shashidhar A. Hexavalent vaccinations: the future of routineimmunization? Indian Pediatr. 2017 Jan 15; 54(1):11-13.
Il PDF dello studio


Nessun commento:
Posta un commento
Nota. Solo i membri di questo blog possono postare un commento.